El movimiento de las células durante nuestro desarrollo embrionario es fundamental para comprender cómo se establecen nuestros tejidos y órganos y, en consecuencia, cómo surge la forma en los seres vivos.
Por eso, conocer los mecanismos en que las células se organizan en este proceso de formación inicial y explicar las leyes que hacen que éstas se muevan en grupo hacia un lado y no hacia otro es crucial para entender nuestros orígenes y de paso, también, el origen y progresión de otros procesos como la de afecciones patológicas como el cáncer, donde las células también realizan movimientos migratorios para colonizar otros órganos.
De allí la importancia del descubrimiento que acaba de realizar un equipo multidisciplinario del Núcleo Milenio Física de la Materia Activa, que revela, por primera vez, las leyes físicas que explican por qué ciertas células embrionarias se mueven hacia los bordes de otras células más grandes, en un período previo a que ambas entren al proceso de diferenciarse para crear órganos o tejidos.
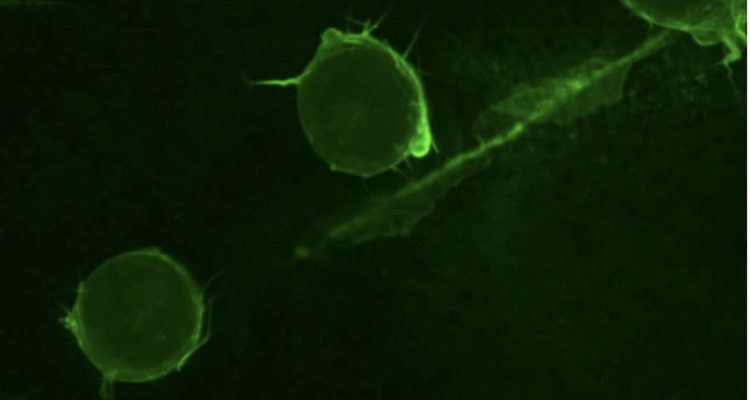
La investigación, donde participaron físicos y biólogos, se realizó por más de un año con estudios in vivo con embriones de peces anuales (killi), que son muy comunes en los acuarios y tienen la ventaja de que sus embriones son transparentes y tienen pocas células embrionarias y de gran tamaño, lo que permite a los investigadores observar más claramente sus movimientos al microscopio.
“Es importante saber cómo y hacia dónde se mueven las células, pues su correcto posicionamiento en las etapas embrionarias permite que se generen adecuadamente los distintos órganos del cuerpo. En nuestro trabajo mostramos que la física -en este caso, la teoría de la elasticidad y de la materia activa- permiten entender ese movimiento”, dice Rodrigo Soto, director del Núcleo Milenio y académico del Departamento de Física de la Facultad de Ciencias Físicas y Matemáticas (FCFM) de la Universidad de Chile.
La investigación
En 2017, los biólogos de la Facultad de Medicina de la Universidad de Chile, German Reig y Miguel Concha, y el físico de la FCFM, Néstor Sepúlveda, estudiaron el pez anual (killifish) en etapa de embrión y descubrieron que tenía dos tipos de células: unas grandes con forma hexagonal que formaban un tejido epitelial (como una piel) y unas más chicas que se movían sobre ellas y que lo hacían, preferentemente, hacia los bordes de las grandes.
Un año después, los físicos del Núcleo Milenio Física de la Materia Activa, Susana Márquez y Rodrigo Soto, se unieron a los investigadores para buscar una explicación a dicho movimiento, sumando a los experimentos biológicos, simulaciones computaciones desde la física teórica. El resultado es la investigación que será publicada en la próxima edición de la revista Physical Biology y donde proponen que en esta organización celular temprana operaría un nuevo mecanismo al que llamaron “estirotaxis”.
“Lo que vimos es que las células grandes de los embriones de este pez están tensionadas (estiradas) por su propia acción. Entonces las chicas se mueven sobre un tejido estirado. Se sabía que las células chicas son capaces de medir qué tan rígido es el sustrato en que están y que se mueven preferentemente hacia donde es más rígido”, explicó Rodrigo Soto.
“En este estudio, mostramos, primero, que un tejido estirado se vuelve más rígido, por lo que las células chicas serán capaces de medir eso y terminar moviéndose hacia donde está más estirado. Y, segundo, mostramos que lo más probable es que las células grandes estén más estiradas cerca de sus bordes, lo que explica, por qué las células chicas se van hacia el borde, pues es la zona más estirada y, por tanto, la más rígida”, agregó.
“Lo que hacemos es proponer la existencia de un mecanismo similar a uno ya conocido -llamado durotaxis-, pero donde las células en lugar de migrar hacia zonas más duras, migran hacia zonas más estiradas”, profundizó Susana Márquez, egresada de magíster en Física del Núcleo Milenio y líder del estudio.
Postulamos que los fenómenos de migración celular, donde las células se desplazan guiadas por señales mecánicas, pueden ser casos de “estirotaxis”, y no sólo de durotaxis. Esto es porque las células “sienten” la dureza aparente, pero ésta no sólo depende de la dureza del material, sino que también del grosor y de estiramiento de éstos”, añadió.
Células madre y cáncer
Miguel Concha, investigador adjunto del Núcleo Milenio Física de la Materia Activa, académico de la Facultad de Medicina de la Universidad de Chile y científico del Instituto Milenio de Neurociencia Biomédica (BNI), dice que el movimiento es una propiedad de comportamiento de la célula que es central para el desarrollo y que, aunque todas células tienen la capacidad de moverse, “este movimiento tiene que ser dirigido”.
“Entender cómo ese movimiento se dirige es importante, porque en el desarrollo embrionario, nos permite entender cómo se genera la forma en el embrión. Y saber cómo ello ocurre nos permite entender nuestros orígenes, es decir, cómo pasamos de una célula a ser individuos con un organismo, con órganos y tejidos”, enfatizó.
Pero eso no es todo. Concha indica que ampliar el conocimiento en los movimientos migratorios de las células permite entender también cómo el cuerpo repara las heridas o cómo el cáncer se propaga, ya que ambos procesos incluyen movimientos celulares.
Asimismo, agrega, abre las posibilidades a nuevas aplicaciones en la medicina del futuro, “pues los mecanismos que estamos estudiando en los embriones, son los mismos que se están usando para crear células madre para producir tejidos y órganos que permitan curar enfermedades o realizar trasplantes”.
En ese sentido, el doctor Concha dice que la física ha permitido entregar herramientas nuevas a una investigación que hasta hace poco se hacía sólo con la experimentación biológica en laboratorio. Una mirada que comparte Susana Márquez.







 Enviando corrección, espere un momento...
Enviando corrección, espere un momento...